二次電池のメカニズムを「活物質の結晶構造」と「化学反応式」からあらためて学ぶ|基礎から学ぶEVバッテリー
カーボンニュートラルの実現や再生可能エネルギーの普及に向け、EV化が加速している。それに伴い、「二次電池」の性能向上が大きな課題となっており、なかでもリチウムイオン電池(LiB)は、EVのパフォーマンスと寿命に大きな影響を与える要素だ。本記事では、正極活物質の開発におけるリチウムイオン電池の歴史をもとに、それぞれの特性について解説。また、次世代電池技術の進展と将来の可能性についても見ていこう。
TEXT:小松暁子
二次電池の定義と充放電メカニズムを知る
二次電池とは、充放電サイクルを繰り返し行うことができる電池である。電気エネルギーを化学エネルギーとして蓄え、必要に応じて取り出すことが可能。一次電池とは異なり、化学反応を可逆的に行うことで繰り返し使用できる仕組みだ。代表的な二次電池には、鉛蓄電池、ニッケルカドミウム(Ni-Cd)電池、ニッケル水素(Ni-MH)電池、そして現在最も広く使用されているリチウムイオン(Li-ion)電池が含まれる。
二次電池の基本原理は、充電時に電気エネルギーを供給して化学エネルギーとして蓄え、放電時に蓄えた化学エネルギーを電気エネルギーとして取り出すプロセスである。
リチウムイオン電池(LiB)の基本構造とメカニズムについて、ここで軽く復習しておこう。
リチウムイオン電池は、軽量で高エネルギー密度を持ち長寿命と、高い効率を誇るため、モバイルデバイス、電気自動車、エネルギー貯蔵システムなどで広く利用されている。リチウムイオン電池の基本構造は、正極、負極、セパレータ、電解質から成り立つ。
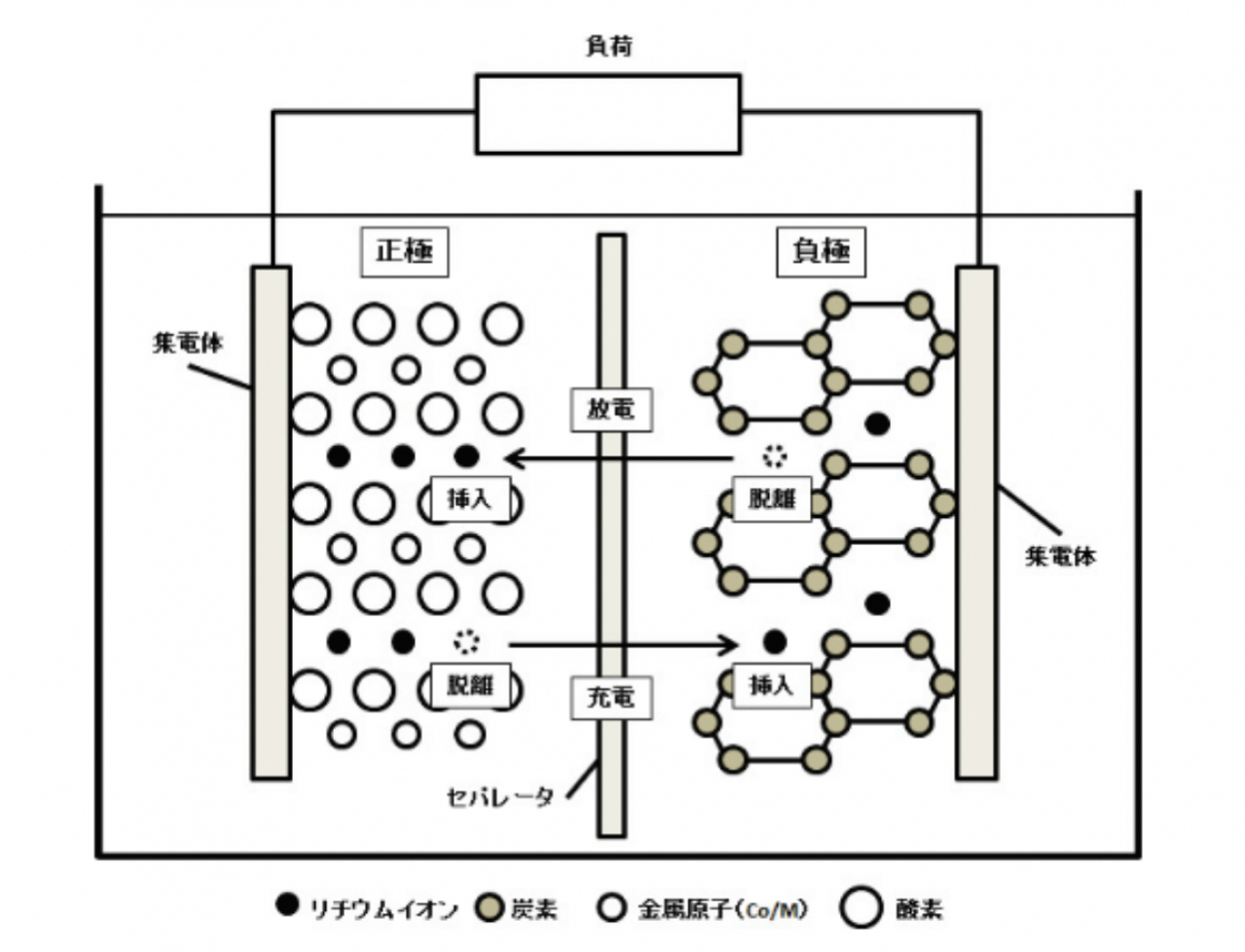
正極材料としては、リチウム金属酸化物(LiMO2、ここでMは金属)、負極材料としては、グラファイト(C6)が一般的に使用される。電解質は、リチウム塩(LiPF6など)を有機溶媒(EC、DMCなど)に溶解したものが用いられる。セパレータは、多孔質のポリマー材料であり、正極と負極を物理的に分離しつつ、イオンの移動を許可する。
充電時には、リチウムイオンは正極から負極へと移動し、電解質を通過して負極に挿入される。このとき、電子は外部回路を通じて正極から負極へと移動する。放電時には、逆にリチウムイオンは負極から正極へと移動し、電子は外部回路を通じて負極から正極へと流れる。これにより、電流が得られる。リチウムイオン電池の充放電反応は以下のように表される。
充電時: LiMO2+C6→Li1−xMO2+LiC6
放電時: Li1−xMO2+LiC6→LiMO2+C6
ここで、LiMO2は正極材料、C6 は負極材料、LiC6 はリチウムが挿入された状態の負極材料である。充電時、放電時は逆反応となり、これに伴う電子の移動が電流として流れる仕組みだ。
正極活物質の開発におけるLiBの歴史
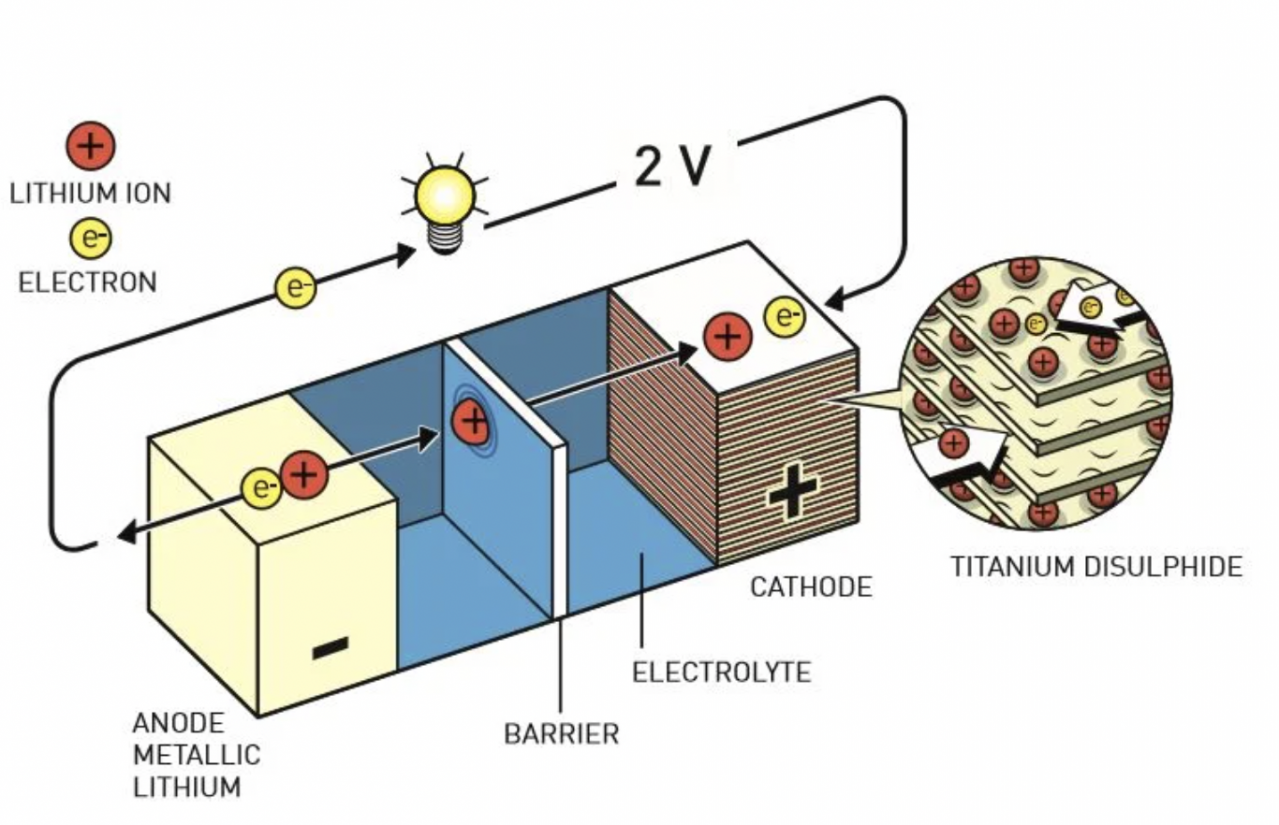
リチウムイオン電池(LiB)の発展は、さまざまな正極活物質の開発とそれに伴う技術革新の歴史でもある。まず、スタンリー・ウィッティンガムが開発したのは正極材料に二硫化チタン、負極にリチウム金属を使用したLiBである。
二硫化チタンとは層状の化合物であり、リチウムイオンが出入りしても構造が壊れにくく、繰り返しの充放電が可能な特性を持つ。この「層状化合物にイオンが出入りする」という概念はインターカレーションと呼ばれ、後の電池材料研究で広く採用される極めて重要な考え方となった。しかし、チタンの硫化物は重量があり、水などに対して不安定なため、より高性能な材料の開発が求められることとなった。
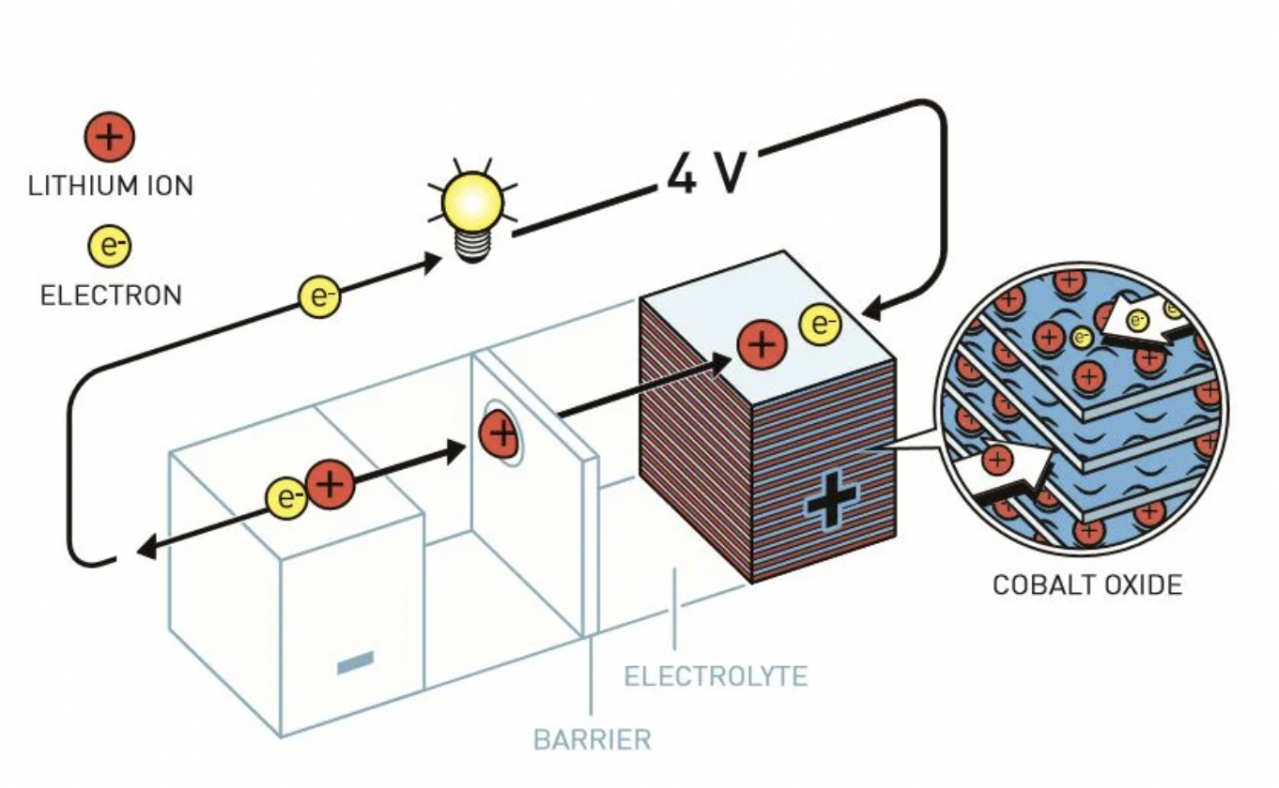
そこで開発されたのがコバルト酸リチウム(LiCoO2)を正極材料に使用したリチウムイオン電池である。これは、1980年ジョン・グッドイナフによる「LiCoO2という酸化物がリチウムイオン電池の正極材料に適している」との革命的な報告から生まれた。
この材料は、酸素と同程度の強い酸化力を持ち、高電圧を実現できる上、層状構造を持つためリチウムイオンの挿入・脱挿が容易に行われる。すなわち、充放電を繰り返しても安定した特性を維持する「使える」材料である。
グッドイナフは物理学者として、酸化物内部の電子の性質に関する理論的な研究で世界的に著名な人物。1958年にはニッケル酸リチウムという類似した化合物を報告しており、その研究を通じて、リチウムを含む酸化物が有望な電池材料であることを示していた。
グッドイナフと、彼の研究室に留学していた水島公一(日本の物理学者・現:東芝エグゼクティブフェロー)らは、リチウムを極めて効率的に出し入れできるコバルト酸リチウムを発見。これが現在も広く利用されているコバルト酸リチウムを使用したリチウムイオン電池の基盤となった。
LiCoO2の結晶構造は、リチウムイオンが充電時に層間から抜け出し、放電時に再挿入されるというメカニズムを持ち、放電反応では以下の式で表される。
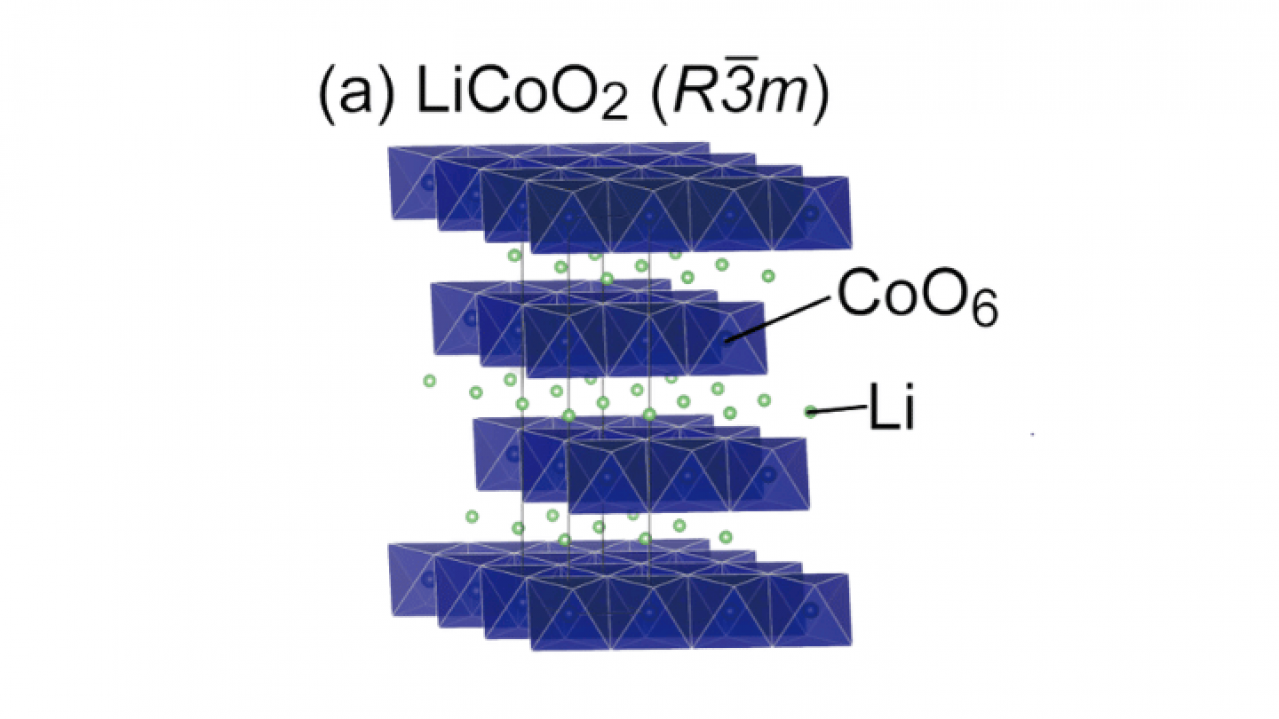
正極: Li1−xCoO2 + x Li+ + xe− → LiCoO2
負極: Lix(C) → C + xLi+ + xe−
全反応: Li1−xCoO2 + Lix(C) → LiCoO2
※充電はこの逆反応となる
このプロセスにより、高いエネルギー密度と安定した電池性能が得られ、従来のマンガン電池や鉛蓄電池よりも小型で高出力という特長があったが、まだ問題もあった。充放電を繰り返す過程でリチウムの表面にデンドライトと呼ばれる針状のリチウム金属が成長。これが正極に到達することでショートを引き起こし、発火の危険を伴うというものだ。また、コバルトは高価なため供給リスクや環境負荷が課題でもあった。
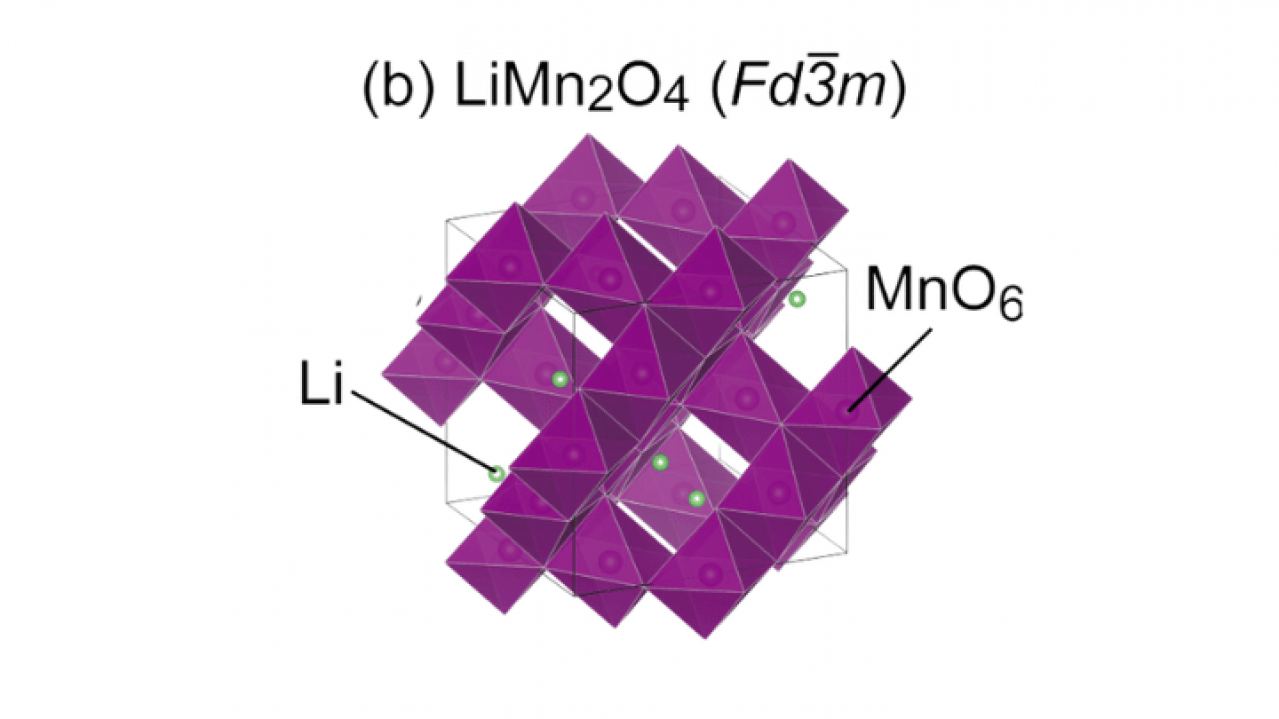
1990年代には、マンガン酸リチウム(LiMn2O4)が登場し、スピネル構造による三次元的なリチウムイオンの移動経路が注目された。LiMn2O4の結晶構造では、マンガン原子が酸素原子に囲まれた八面体構造を形成し、その中にリチウムイオンが配置される。この三次元構造により、リチウムイオンの高速移動が可能となり、高い出力特性と優れた熱安定性が実現される。LiMn2O4の充放電反応は以下のように表される。