FCEVの可能性を拓く次世代水素キャリア「水素化マグネシウム」は実用化可能なのか。製造過程から見えてくる「消費エネルギー」の壁

水素エネルギーは、クリーンで再生可能なエネルギー源として注目されており、脱炭素社会の実現に向けた重要な技術として注目を集めている。しかし、FCEV(燃料電池車)の普及はまだ途上にあり、特に水素の貯蔵と輸送に関する課題が障壁となっている。
従来の高圧タンクや液化水素輸送には、コストや安全性の問題があり、FCEVの普及を妨げている。こうした課題に対して、革新的な水素キャリア「水素化マグネシウム(MgH2)」が登場した。
2024年4月、化学工業の分野で長い歴史を持つトクヤマが、バイオコーク技研と共同で開発を続けていた水素化マグネシウムの量産開始を発表。バイオコーク技研の研究開発力と、トクヤマの生産技術が相互補完的に機能し、これまでにない規模での水素化マグネシウムの量産が可能となった。
この新しい水素キャリアは、FCEVの普及を後押しする救世主となるのか。その可能性を探る。
TEXT:庭野ほたる(Hotaru Niwano)
目次
水素化マグネシウムとは何か?

水素化マグネシウム(MgH2)とは、マグネシウムに水素を化学的に結合させた化合物であり、次世代の水素キャリアとして注目されている。具体的には、マグネシウム原子(Mg)1molに対して2molの水素原子(H)が結合し、水素化マグネシウム(MgH2)1molを形成する。
この化合物は、比較的高い水素含有量(約7.6質量パーセント)を持ち、水素を高密度で貯蔵できるのが特徴だ。
通常、水素は気体の状態で存在し、分子が広がっているため密度が低くなる。しかし、MgH2のように固体の中に水素を取り込むと、気体よりもずっと高い密度で水素を保持できる。つまり、MgH2は、質量の約7.6%に相当する水素を保持できる高効率な水素キャリアとしての役割を果たす。
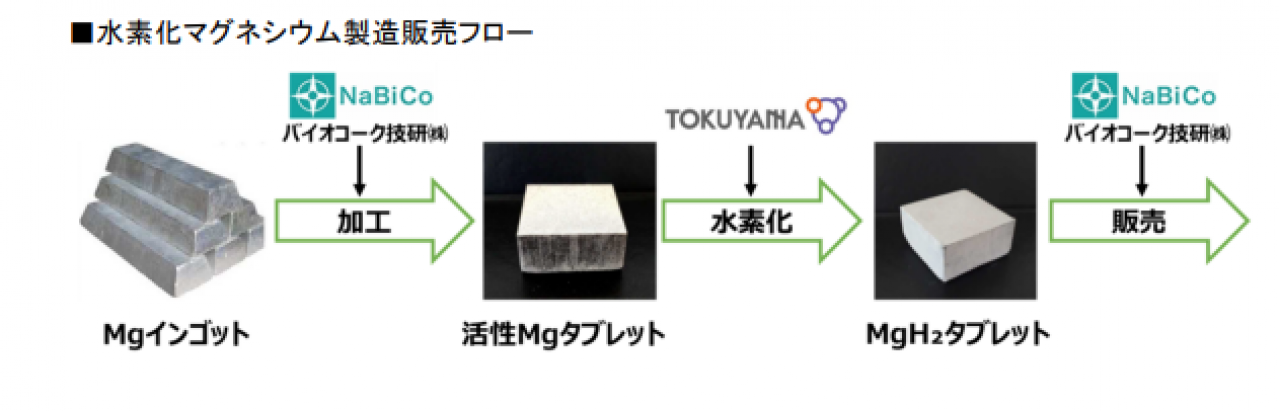
水素化マグネシウムはどのように製造されるのか

水素化マグネシウムの製造方法には、ジエチルマグネシウム(MgEt2)の熱分解による合成法と、マグネシウムと水素を高温高圧下で直接反応させる方法の2つが知られている。
MgEt2 → MgH2 + 2C2H4 …(1)
Mg + H2 → MgH2 ΔH= -74kj/mol …(2)
(1)式がジエチルマグネシウムを用いた反応式、(2)式がマグネシウムと水素の反応式である。
(1)式で得られるMgH2は非常に反応性が高く、水や空気と接触すると発火する恐れがある。一方、(2)式で得られるMgH2は、表面が酸化物などの皮膜に覆われている。そのため、空気中では安定しているが、水と接触するとゆっくりと分解する。通常、工業的にMgH2を作製する際には、この(2)式のプロセスが採用される。
(2)式の製造プロセスにはいくつかの方法がある。ここでは、バイオコーク技研から発表されている論文の中から「粉砕-活性化処理法」の製造プロセスを紹介する。
(参考元:技術報告 軽金属 第60巻 第11号(2010),615–618「水素貯蔵材料 MgH2 の製造と応用」)
ステップ1:マグネシウムの準備
まず、マグネシウムを粉砕して小さな粒子にする。微粒子化により、マグネシウムの表面積が増え、より多くの水素が取り込まれるようになる。
ステップ2:高温高圧環境での反応
次に、粉砕したマグネシウム(Mg)を水素ガス(H2)と一緒に高温・高圧の環境に置く。この条件下で、マグネシウムは水素を吸収し始め、水素化マグネシウム(MgH2)が形成される。
ステップ3:活性化処理
生成されたMgH2には、反応をさらに効率化するために「活性化処理」を施す。活性化処理とは、生成されたMgH2を一度加熱して水素を放出させ、再度水素を吸収させる工程を繰り返すことをいう。この「水素の吸収⇆放出」を10回以上繰り返すことにより、95%程度の水素化が達成される。
「加水分解」による高効率な水素生成が水素化マグネシウムの強み
水素化マグネシウムの強みは、水素を効率的に取り出せる「加水分解反応」にある。
加水分解反応は、水素化マグネシウム(MgH2)を水(H2O)と反応させることで、水素(H2)を取り出す化学反応だ。この反応では、以下のような化学反応式が成り立つ。
MgH2 + 2H2O →Mg(OH)2 + 2H2 ΔH=-277kj/mol … (3)
この式の通り、水素化マグネシウムが水と反応することで、水酸化マグネシウム(Mg(OH)2)と水素(2H2)が生成される。
また、加水分解反応は温度に大きく影響される。具体的には、以下のような特性がある。
室温(常温)では、反応は比較的ゆっくり進行する。この水素化マグネシウムを加熱すると、水との反応が促進され短時間で大量の水素が生成される。この特性は、FCEVのようなエネルギー供給が即座に求められる場面で特に有効であり、水素化マグネシウムの活用が期待される理由の一つだ。
常温常圧での安定性が水素キャリアにつながる
水素化マグネシウムは、常温常圧で安定しており、安全性が高いという特性も兼ね備えている。
前述の(2)式で生成された水素化マグネシウムは脱水素化時のエンタルピー(熱含量)が高い。これは水素がマグネシウムから分離するために多くのエネルギーを必要とすることを意味する。そのため、常温常圧では水素が容易に放出されず、安定した状態を保つ。
また、水素化マグネシウムの製造過程において、酸化マグネシウム(MgO)や水酸化マグネシウム(Mg(OH)2)、窒化マグネシウム(Mg3N2)といった酸化物や水酸化物の薄い層が形成される。これが保護膜として機能し、水酸化マグネシウムを外部環境から保護する役目を果たす。この保護膜があることで、水酸化マグネシウムは大気中でも安定して存在し、発火や爆発のリスクが低くなる。
そして、この安定性こそが、水素キャリアとしての強みとなり、従来の高圧ガスや液化水素を扱う方法に比べ、安全で取り扱いやすい水素貯蔵・輸送手段を提供している。固体として水素を貯蔵することで、ガス漏れや爆発のリスクを低減し、輸送中の安全性が大幅に向上するだけでなく、既存のインフラを利用したコスト効率の良い輸送が可能となる。