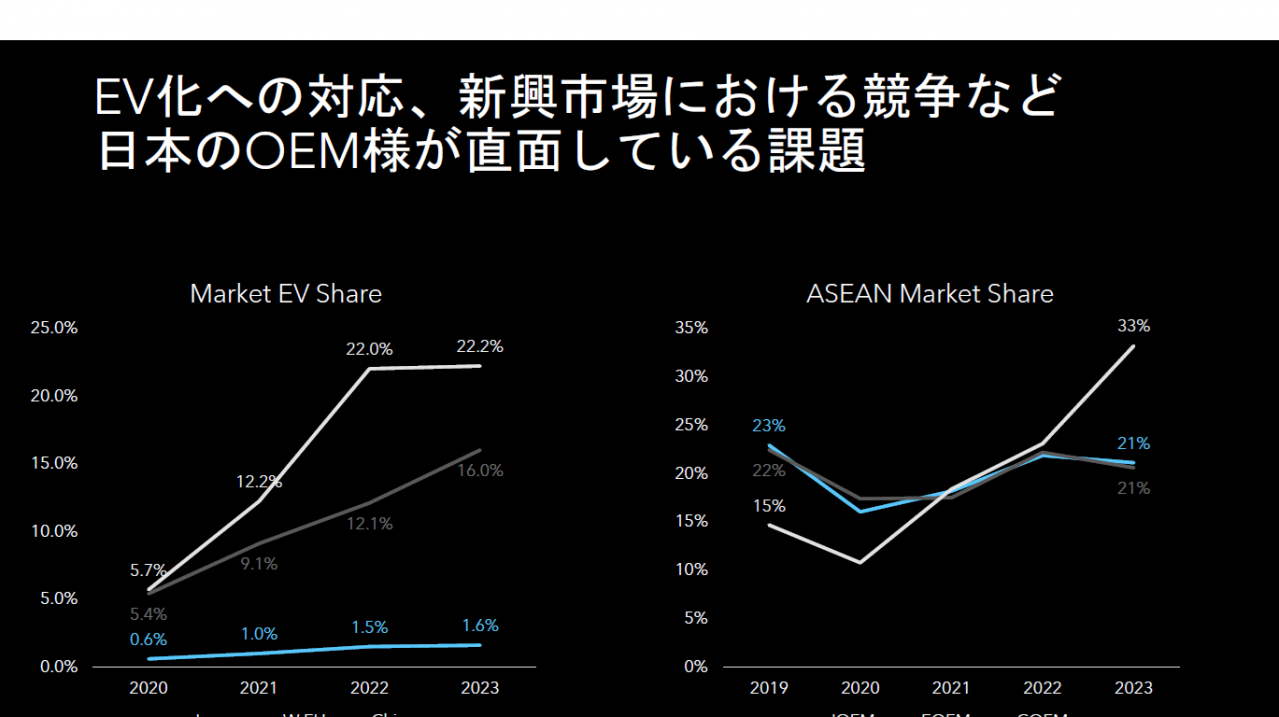
EV用バッテリーの化学|「NMC対LFP」の構図【EVの基礎まとめ Vol. 4】
電力供給の「持久力」か、それとも「瞬発力」か、あるいは「急速充電耐性」か——。2次電池のキャラクターはそのまま搭載車両の性能に直結し、少なからず使い方の自由度を制限する。そしてその性能は、極材に使われる金属が持っている「そもそもの性質」の影響を受ける。三元系正極材とリン酸鉄リチウムについて、MotorFan illustrated 198号(2023年4月)から抜粋して紹介する。(情報は当時のもの)
TEXT:牧野茂雄(Shigeo MAKINO) FIGURE:萬澤琴美(Kotomi MANZAWA)
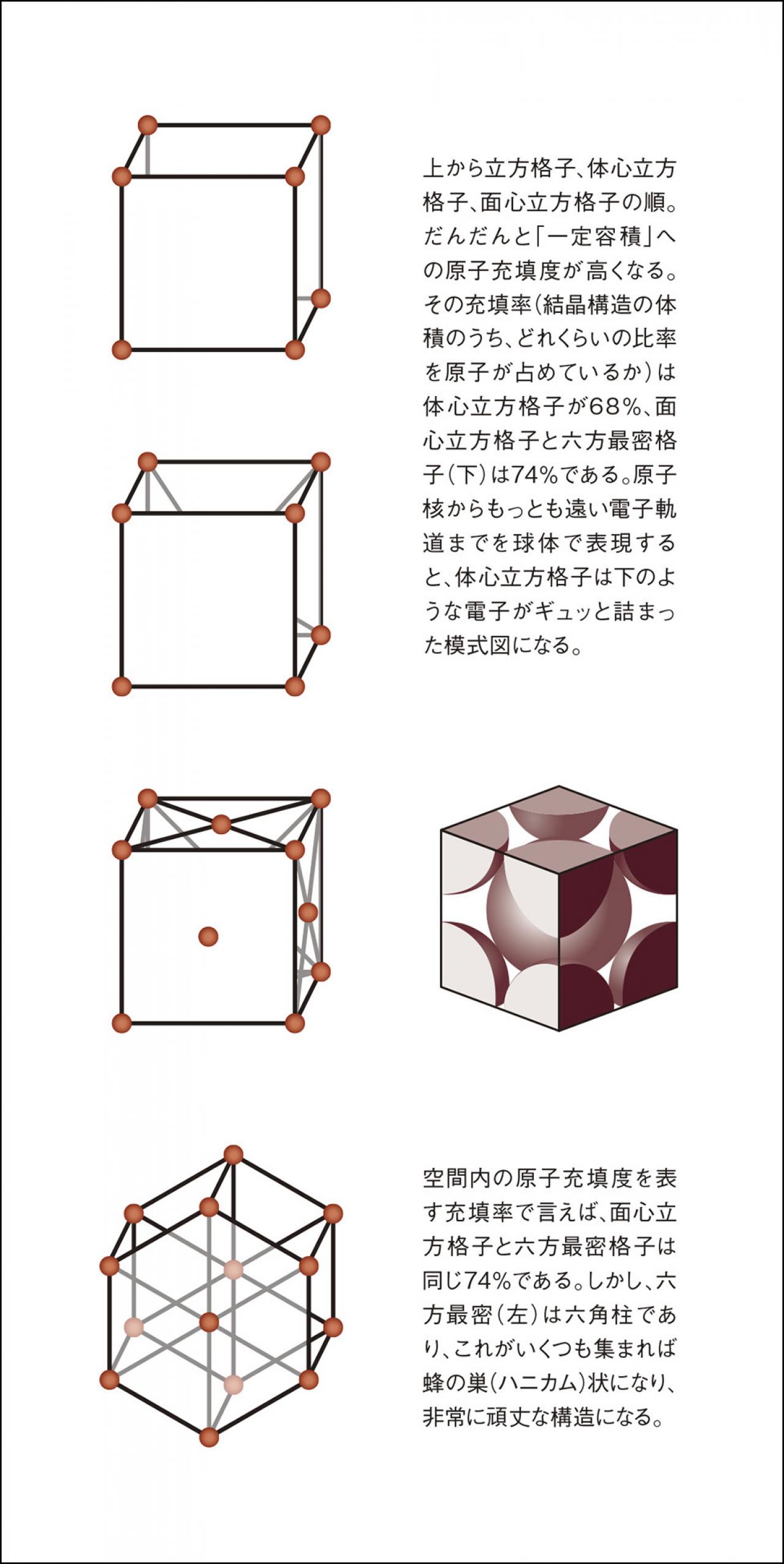

身のまわりにある電池は、ほとんどが「化学電池」だ。正極(+)と負極(−)にそれぞれ金属を使い、両方の金属は共通の電解質(液体の場合は電解液)に浸されている。電位の高い側が正極、低い側が負極になる。また、正極と負極にはそれぞれ、電気の「取り出し口」としての電極が取り付けられている。
この両方の電極の間に何かの回路(電球でもいい)を入れると正極電極〜回路〜負極電極がつながり、正極と負極が同居している電解質の中をプラスのイオンが移動する。イオンを放出した側の極材中の原子にはマイナスの電子が残っており、その電子が電極から回路へと放出され、反対側の電極へ移動する。このときに電子のエネルギーによって回路が作動する。
普通の乾電池のような「使い切り」の1次電池は、負極から正極へ電子が移動する「放電」だけが行なわれる。電解質の中の物質が移動してきたイオンを捉え、そこで化学反応は終わる。回路の中を流れた電子は、回路を作動させたのちに電解質の中に消えてゆく。「電気切れ」とは、準備された化学反応ポテンシャルを使い切った状態である。
いっぽう、「繰り返し」使える2次電池は、充電と放電の両方が可能だ(下右図参照)。電解質内をイオンが負極側から正極側へと移動することで、残された電子も負極から正極へと流れ、その途中にある回路(たとえばモーター)を作動させる。そして、回路を充電に切り替えると、正極側に移動していたイオンが負極側へと戻り、電子も同じように負極側へと戻る。
自動車を走らせる動力を得るために使われているリチウムイオン2次電池(以下=LIB)は、この「2次電池」であり、繰り返して使うことができる。ここでは電池の仕組みを詳しく述べないが、化学電池から放出される電流は、すべての物質が持つ「電子」であり、電子を放出させる化学変化がそこで行なわれる。前述のように正極と負極の間の「電子」と「イオン」の移動が放電と充電を司っている。LIBはリチウムのイオン「Li+」が電子を移動させるキャリア(乗り物)としての役割を果たす。
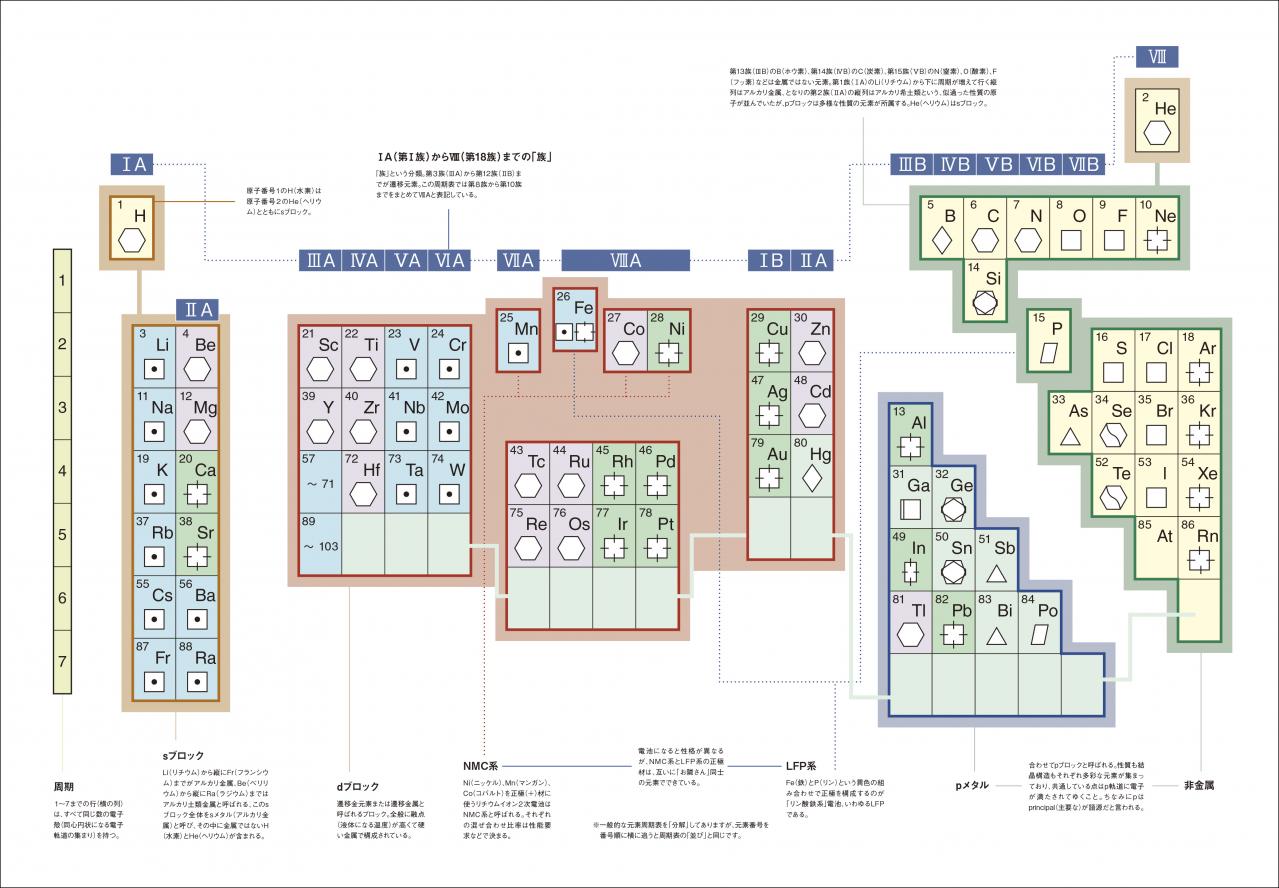
LIBで正極と負極に使われている金属は、左図下側の化学式と右図に示した化学式のように必ず、「Li=リチウム」を含んでいる。Liは原子番号3。2周期の1族(IA)に属するsブロックの金属であり、原子間の距離が長く結合力が弱いためイオンの移動自由度が高い。そして、Liと結合している物質は、正極ではMn/Ni/Co/Feなど、負極ではC/Si/La/Sn/Tiなどだ。Liとこれらの物質をくっつける理由は「棚」を作ることだ。その様子を模式的に表したものが、下図左に示した模式図である。